I.
Naissance et Evolution d’un cancer.
1) Genèse d’un
cancer (ou oncogenèse)
Les cancers sont des maladies dues à un dérèglement de la division cellulaire dans des cellules qui vont alors proliférer après avoir perdu une partie ou la totalité du contrôle normal de cette division.
On
distingue trois groupes de cancers :
- Les carcinomes ou cancers des cellules
épithéliales (cellules de revêtement, peau par exemple) qui représentent la
majorité des cancers
- Les sarcomes ou cancers du tissu
conjonctif (tissu de soutien présent dans l’organisme, os ou muscles par
exemple)
- Les hématosarcomes ou cancers des
cellules sanguines (leucémies, myélomes et lymphomes).
Le cancer est une maladie aux causes géniques : le génome
humain possède une multitude de gènes spécifiques de l’apparition ou non d’une
tumeur cancéreuse. Parmi eux on trouve des gènes régulant la division
cellulaire :
- Les
proto-oncogènes sont des gènes
qui stimulent la division cellulaire. Dans un cancer, ils existent sous forme
anormale, dite oncogène. On comprend bien que l’activation excessive de ces
gènes conduit à un dérèglement du cycle cellulaire vers une division
incontrôlée.
L’influence de ces gènes est dite
dominante car il suffit qu’un seul allèle soit touché (mutation sur une seule
copie du gène) pour déclencher une division cellulaire anormale. Beaucoup de
ces gènes ont été identifiés dont les plus connus sont Ras, Myc ou Abl.
- Les
gènes suppresseurs de tumeurs, appelés aussi anti-oncogènes, jouent le rôle d’inhibiteurs de la
division cellulaire. Contrairement aux proto-oncogènes, il est nécessaire que
les deux copies du gène soient mutées pour lever l’inhibition de la division
cellulaire. On connaît actuellement une vingtaine de ces gènes (dont le gène
P53).
- Les
gènes de l’apoptose
ont été reconnus récemment pour participer également à la régulation du cycle
cellulaire. L’apoptose ou mort cellulaire programmé est un processus biologique
normal s’effectuant par exemple lors du développement embryonnaire ou quand une
cellule est anormale et pourrait devenir dangereuse pour l’organisme. C’est un
phénomène régulé par des gènes activateurs et inhibiteurs. Si l’équilibre se
rompt en faveur d’une inhibition de l’apoptose, la cellule peut devenir
"immortelle".
Actuellement
les scientifiques supposent qu’il faut une modification de 7 à 10 de ces gènes
pour qu’une cellule passe d’un état normal à un état cancéreux. Sachant qu’il
existe au moins 50 gènes de chacune des trois catégories, le nombre de
combinaisons pouvant conduire à une tumeur est très élevé. Ce sont ces
combinaisons qui sont à la base de la diversité des cancers.
Comment l’activité
d’un gène peut-elle être altérée?
Dans le noyau d’une cellule, le matériel
chromosomique est assez fragile : des translocations chromosomiques
peuvent avoir lieu, c’est-à-dire qu’à la suite de cassures chromosomiques, les
différents fragments produits peuvent se réassembler selon un profil qui n’est
pas celui d’un caryotype normal. C’est ainsi qu’un proto-oncogène peut se
réunir avec un chromosome autre que le sien et cette réunion peut sur-exprimer
le proto-oncogène, le stimuler, ce qui a des conséquences dévastatrices (le
plus bel exemple en la matière est celui du chromosome Philadelphie qui fait
intervenir une translocation réciproque entre les bras longs des chromosomes 9
et 22. La translocation juxtapose le proto-oncogène c-abl sur le
chromosome 9 au gène bcr sur le chromosome 22. Il en résulte un gène dit
chimérique qui code une protéine de fusion anormale au pouvoir oncogénique.).
Dans le cas inverse, un chromosome peut perdre un gène qui sera définitivement
perdu (ne se réunira pas avec un autre chromosome). Voilà pourquoi un
anti-oncogène peut être perdu et donc ne pas s’exprimer.
L’activité d’un gène peut sinon être
modifiée par une altération de sa séquence en ADN,
c’est-à-dire de l’ordre des nucléotides de l’ADN (la modification de très peu
de nucléotides peut avoir un impact majeur sur l’activité du gène !).
Ainsi la modification de la séquence d’un gène suppresseur de tumeur peut le
désactiver.
Quels peuvent être
les facteurs de cette modification?
Une telle altération au niveau
de l’ADN est souvent causée par des agents carcinogènes comme le tabac, les
radiations (souvent responsables de translocations chromosomiques), ou encore
des produits chimiques cancérigènes (qui sont partout dans la vie courante et pour la plupart imprévisibles).
Un cancer peut aussi être d’origine virale. Dans tous les cas,
un gène code pour la production d’une protéine. Cette protéine définira le
métabolisme de la cellule et donc son phénotype. Les virus responsables de la cancérisation
d’une cellule, dont le papillomavirus, produisent des protéines qui se fixent
sur celles produites grâce aux gènes suppresseurs de tumeur de la cellule-hôte
du virus ; ces protéines sont alors inactivées, ce qui permet à la cellule
de se diviser anarchiquement. Le papillomavirus est responsable d’environ 6%
des cancers.
2) Caractéristiques
acquises par la cellule cancéreuse (au niveau du phénotype)
Tout au long de sa vie, une cellule suit un
cycle d’activités bien défini appelé cycle cellulaire. Voici les différentes
étapes de celui-ci (chacune étant désignée par une lettre) :
G1 : phase
post-mitotique. La cellule exerce normalement ses fonctions physiologiques (son
métabolisme) pendant cette phase.
S : duplication de l’ADN
en vue d’une mitose (division cellulaire). Cette phase dure 1/3 de la durée
totale du cycle.
G2 : phase prémitotique.
La cellule diminue sa synthèse d’ADN.
M : mitose : la
cellule (appelée cellule mère) se divise en deux cellules filles.
G0 : phase de réserve.
La cellule recommence le cycle ou meurt.
Division anarchique de la
cellule cancéreuse :
Il existe de protéines régulant ce cycle
cellulaire (dans une cellule normale), notamment le passage de la phase G1 à la
phase S. Par exemple, le gène codant pour la synthèse de la protéine Rb est
considéré comme le verrou du cycle cellulaire. Sous sa forme active, Rb est
capable de freiner le passage de G1 à S, limitant ainsi la duplication de
l’ADN, et donc par conséquent la division cellulaire (elle-ci dépend justement
de la duplication de l’ADN). Mais suite à des mutations au niveau du gène, Rb
peut être désactivée, ce qui implique des duplications d’ADN incontrôlées, et
donc des divisions cellulaires anarchiques.
De plus, les cellules d’un même tissu de
l’organisme s’envoient souvent des signaux, chaque cellule obéissant aux
signaux qu’elle reçoit, ceux-ci lui indiquant par exemple de plus ou moins se
diviser, selon les besoins du tissu. Or, les cellules cancéreuses n’obéissent
pas à ces signaux, se divisant anarchiquement en toutes circonstances.
Voilà donc les deux plus importants facteurs
de la division anarchique de la cellule cancéreuse.
Apoptose et cellules
cancéreuses :
La vie et la mort des
cellules de l’organisme sont contrôlées, d’une part par des gènes pro-apoptotiques
tels que c-myc, p53, sollicitent le suicide programmé de la cellule, appelé
apoptose. D’autre part, des gènes de survie ou anti-apoptotiques comme le gène
bcl-2 maintiennent la cellule en vie.
Dans les cellules
cancéreuses, le problème se situe au niveau du premier type de gènes
cité : chez les cellules normales, dès qu’une lésion d’ADN est détectée
dans le noyau de la cellule, le gène p53 provoque (en codant pour la synthèse
de protéines spéciales) l’arrêt du cycle cellulaire (début de la phase G0). Les
lésions sont alors réparées, ou l’apoptose est déclenchée. Ainsi, la mutation
des gènes pro-apoptotiques interdit toute apoptose : les cellules
s’accumulent alors sans mourir.
Immortalité de la cellule cancéreuse :
Attention : ici,
« immortalité » veut dire prolifération illimitée.
Dans le noyau de toute
cellule se trouvent aux extrémités des chromosomes des séquences répétitives,
qui ne sont pas des gènes, appelées télomères, et qui s’usent à chaque
duplication d’ADN : ces télomères finissent donc, au bout d’un certain
nombre de duplications, par disparaître. Dès que celles-ci ne sont plus là,
c’est-à-dire dès que les extrémités des chromosomes ne sont plus protégées, la
duplication s’arrête à jamais. C’est ce qui explique le nombre limité de duplications
d’ADN, et donc de divisions cellulaires, d’une cellule au cours de sa
vie : cette limite est appelée limite d’Hayflick, aux alentours de 20 à 60
pour les cellules de l’Homme).
Animation cellule normale (cliquez sur le
lien pour visionner l’animation).
Dans les cellules cancéreuses
il y a surexpression des gènes codant pour la fabrication de télomérases
(enzymes catalysant l’ajout de télomères à l’extrémité des chromosomes). C’est
ainsi que dans les cellules cancéreuses, il n’y a pas « érosion » des
télomères, et l’ADN peut être dupliqué indéfiniment, et donc la cellule peut
être divisée anarchiquement.
Animation cellule cancéreuse (cliquez
sur le lien pour visionner l’animation).
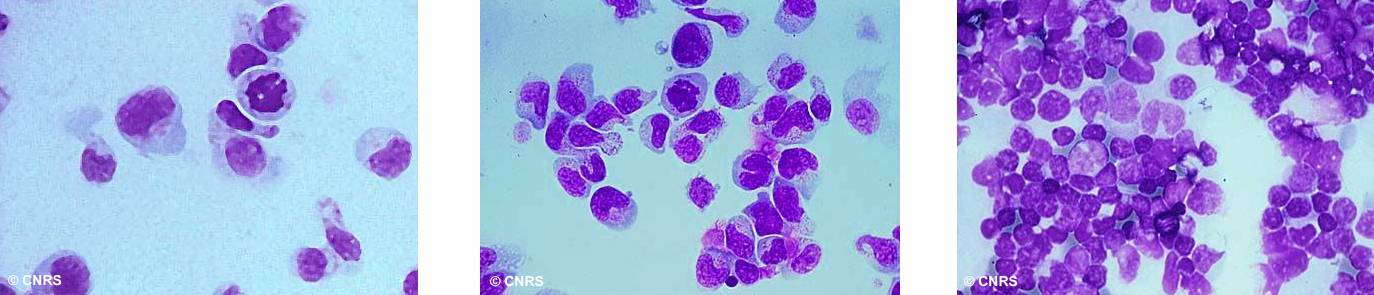
Division cellulaire anarchique.
Enfin, une cellule cancéreuse acquiert la capacité de s’échapper
de son tissu d’origine pour métastaser, ce qu’une cellule « normale »
ne peut pas faire.
Conclusion :
La transformation tumorale ou transformation
néoplasique se fait en 3 étapes :
- L’initiation
qui a pour origine la mutation d’un proto-oncogène ou d’un gène suppresseur de
tumeur (également appelé anti-oncogène)
- La promotion
due à une augmentation des capacités de la cellule à proliférer (elle perd
notamment son inhibition de contact, c'est-à-dire la capacité qu’elle a
normalement de s’arrêter de se diviser au contact des cellules voisines ;
par ailleurs elle peut se diviser en absence de signaux déclencheurs comme les
facteurs de croissance)
- La progression tumorale
qui résulte du fait que les cellules cancéreuses échappent à la fois au système
immunitaire et aux mécanismes de mort cellulaire programmé.
Donc
il s’écoule en général plusieurs années entre l’apparition de la première
cellule cancéreuse et la formation d’une tumeur décelable par palpation ou
radiographie.
3) Evolution d’un
cancer : Tumeur, Angiogenèse, et Métastases.
En se multipliant, les cellules
cancéreuses vont alors former un amas de cellules transformées qu’on nomme tumeur.
Cette tumeur
primaire a une origine clonale car les cellules qui la composent sont toutes
issues de la cellule mutée initiale.
La tumeur est dans un premier temps isolée de tout vaisseau
sanguin ou lymphatique. Elle est pour le moment de petite taille, donc
difficile à détecter. Lorsque la tumeur grossit pour atteindre la taille d’1
cm² environ (ce qui correspond déjà à des milliards de cellules), la tumeur
trouvera le moyen de se répandre dans l’organisme. Grâce à des facteurs
chimiques, la tumeur peut attirer vers elle un vaisseau sanguin (ou
lymphatique). Lorsque la tumeur est assez proche de celui-ci, elle libère des
enzymes appelés protéases qui vont dégrader la membrane basale vasculaire (MBV)
et libérer ensuite des hormones de croissance qui vont provoquer la formation
d’une nouvelle ramification de ce vaisseau, ou néovaisseau, qui alimente la
tumeur et lui permet encore de se développer. La formation d’un néovaisseau est
appelée angiogenèse.
Animation
angiogenèse (cliquez sur le lien pour visionner l’animation).
La tumeur peut libérer des cellules
cancéreuses, qui emprunteront le vaisseau sanguin (ou lymphatique). Une
fois « installée » dans un nouvel organe, la cellule cancéreuse va de nouveau
se multiplier et former une tumeur secondaire nommée métastase. La multiplication du nombre des
métastases conduit à ce que l'on appelle souvent un cancer
"généralisé".
Les cancers du sein se métastasent presque toujours dans les mêmes organes. La molécule chémokine CXCL12, (produite par certains organes comme le foie, la moelle osseuse ou les poumons), ramène vers les organes dont elle est issue, des leucocytes ou des cellules indifférenciées. Cette molécule, pouvant s’associer à une protéine présente sur la cellule cancéreuse, ramènent alors le cancer vers son organe d’origine, ce qui provoque des métastases.